11月28日,FDA发布公告宣布,FDA生物制剂部门正在对CAR-T细胞疗法可能引发继发性癌症的相关风险展开进一步调查。受此利空消息影响,j9九游会老哥俱乐部app科济药业-B(02171)在11月29日盘中最大跌幅也超过了20%。
当时智通财经APP分析到,这则公告意味着FDA未来可能会针对CAR-T产品引发的继发性癌症现象采取更直接的监管行动,例如对已批准产品附加黑框警告内容。如果FDA是针对所有CAR-T疗法的要求都趋于严格,并让所有产品都面临黑框警告风险,对于CAR-T在研厂商来说,其产品未来的上市进程势必会受到影响。
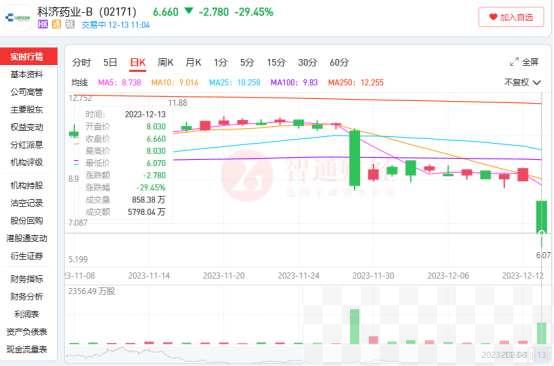
结果不到半个月,科济药业便感受到了来自FDA的“雷霆打击”。12月12日,科济药业宣布,公司在美国的子公司CARsgen Therapeutics Corporation于北京时间12月11日晚上收到FDA通知,要求暂停CT053(BCMA CAR-T)、CT041(Claudin18.2 CAR-T)和CT071(GPRC5D CAR-T)的临床试验,等待对位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。
目前来说,科济将被迫暂停所有在美进行的细胞治疗临床试验。


受此利空消息影响,12月13日,科济药业开盘低开低走,早盘股价最大跌幅达到35.7%,公司股价也触及了上市以来的新低。

值得一提的是,FDA此次是从CMC角度对CAR-T疗法研发企业进行审查。
智通财经APP了解到,CMC(Chemistry, Manufacturing, Controls) 主要涉及药品本身(生产工艺、质量控制、药品特性和稳定性等)以及生产过程中用到的设备(设备设计、操作规程、维护保养等),目的是提供足够的证据确保产品的安全性、特异性、质量、纯度和效价。其直接关系到重要的风险因素和临床试验乃至药品上市的进展。
因此,细胞疗法产品在IND和NDA/BLA申报时,CMC都是文件体系中的重要部分。典型的BLA/MAA申报文件通常有数千页,有的甚至多达上万页。而之所以需要如此海量的数据,在于,与传统生物药不同,细胞疗法产品需要提交从端到端的生产到每个病人样本和治疗产品的物流信息,以及从每个病人的临床数据到所有病人的汇总分析。
早在2020年FDA便发布了针对于先进疗法的CMC指南,旨在规范化CGT药品的CMC内容。当年就有14个药品由于CMC问题被推迟。
实际上,此次科济药业被查并非存在具体问题和风险,根据公司公告描述更像是FDA收紧CAR-T疗法审查后的一次“突击检查”。科济药业也透露将对现行药品生产质量管理规范(cGMP)进行全面检查和改进,并承诺与FDA密切合作,解决检查发现的问题,以确保临床试验和上市申请的顺利进行和高质量生产。
虽然在业务上或许只是一次例行检查,但在投资者看来,更快且更严苛的产品审查意味着科济药业的产生上市进程被打断,公司造血进程也被迫延迟。
根据科济药业披露的2023年中报,公司为了进一步推进管线内研发进程,公司中期净亏损较上年同期扩大7.5%至4.04亿元。
不过值得一提的是,科济药业其实在研发领域成果颇丰。今年下半年,科济药业GPC3 CAR-T治疗肝细胞癌甚至出现两例逾7年无病生存案例,且这两例长期无病生存案例还在《Cancer Communications》杂志发表并被录用为封面论文。
并且近日,科济药业泽沃基奥仑赛注射液的研究成果还在2023 ASH年会上亮相。根据公司披露的数据,LUMMICAR-1研究中的I期临床试验中对既往经多重治疗的R/R MM人群进行了为期3年的随访,结果显示泽沃基奥仑赛注射液具有令人鼓舞的安全性,其深度和持久的反应与初步结果一致。
只是,随着科济药业成为此次FDA对CAR-T企业“严打”的典型,投资者信心被极大地打击,而公司出现的研究成果与股价表现的割裂,目前似乎只能用“缺乏造血能力压制估值”来解释。因此此次FDA的监管措施显然已成为其核心产品未来商业化以及估值增长的“绊脚石”。